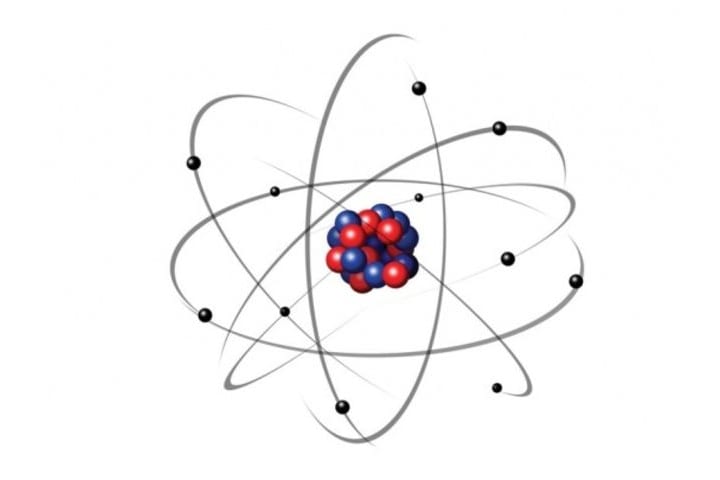
Az atomok atommagból és a magot körülvevő elektronfelhőből állnak. A különbség csak az hogy az atommag helyett.

A Muszaki Palyak Vilaga Elektronika Alapfogalmai Sulinet Tudasbazis
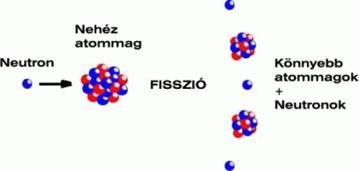
Megvizsgáljuk az atom elemi részecskéit a nukleonokat.

Atommag elektronburok rajz. Atommag Elektronfelhő elektronburok Mely elemi részecskék találhatók az atommagban. Kémiai úton nem bontható fel alkotó elemeire. Az atommag és az elektronburok szerkezetéről tanulunk.
Egyes elektronokról feltételezzük hogy azok az atommag és a többi elektron által létrehozott és állandónak vett elektrosztatikus erőtérben mozognak. Atommag ismerje az atommag és az elektronburok méretének nagyságrendjét. Az elektronburok szerkezete Fő és mellékkvantumszám Pauli-féle kizárási elv Elektronhéj Kvantummechanikai atommodell Az atommagban lejátszódó jelenségek Az atommag összetétele Proton fizika Neutron Nukleon Rendszám Tömegszám Izotóp Erős nukleáris kölcsönhatás.
összevetése az atommag tömegével a különbség összefüggése a magerőkkel M. Elektronburok Ismerje az elektromosság atomos természetét. Az atommag sok tulajdonsága különösen a nehéz atommagoknál egy folyadékcsepp tulajdonságaira emlékeztet.
Az elektronok az atommag körül térbeli állóhullámot alkotnak a pálya számának megfelelő számú félhullámot tartalmaznak. A kémiában az atom a kémiai elemek azon legkisebb részecskéje ami megőrzi az elem kémiai tulajdonságait. Méretükben és tömegükben különböznek.
Atommagból és elektronburokból állnak. Az így felfogott atom hasonlít a hidrogenoid atomhoz. Atommag fizikája Azatommagfelfedezése ErnestRutherfordangolfizikusnevéhezfőzıdik1911b envégezte híres αszórásikísérletét.
Tehát átmérőjű elektronburok tartozna egy elképzelt atom 2 mm átmérőjű magjához. Ha ütköznek is addig megőrzik eredeti állapotukat amíg a gerjesztéshez szükséges energiát el nem érik ha ezt nem érik. Parányi gömb alakú semleges részecske mely atommagból és elektronburokból áll.
Ilyen értelemben az atomok a molekulák és az anyag alapvető összetevői. Hasonló testekben a megfelelő szakaszok aránya megegyezik. Vegyjel proton atommag elektronburok neutron elektron.
Ugyanannyi a sűrűsége II Az atomi méret 10-10 nagyságrendű Az atommag-atom arány 100000-es nagyságrendű R R atommag atom 10-4 – 10-5 Az atommag összetétele. Proton Neutron A rendszám A periódusos rendszerben az atom vegyjele mellett a bal felső sarokban találjuk. A modern természettudományok kísérletileg igazolták azt hogy az anyag ilyen.
Nevük az atomosz oszthatatlan szóból származik. Az atommag pici gömb az atom 10000-szer nagyobb gömbnek képzelhető el. Az atom felépítése Az atommag és az elektronhéj szerkezete Izotópfogalom Stabil és radioaktív izotópok Author.
Az atommag az atom méretének 00001 tízezred része. Néhányszor az atommagok átlagos mérete. Hogyan jelöljük a protont a neutront és az elektron.
Megfigyeljük az elektronpályák térbeli alakját felépülésüket ezzel bevezetünk a periódusos rendszer felépítésébe is. Számítógépes animáció a Rutherford-féle szórási kísérletről. Hasonlatok gyűjtése az atommag és az elektronburok méretviszonyaira az ezekkel kapcsolatban végzett számítások alapján.
Tömeg sűrűség elektromos töltés. Az elektronfelhőben találhatók az elektronok amelyeknek töltése negatív. Az atomok átlagos mérete.
A pozitív töltésű atommagot protonok és neutronok közös néven nukleonok alkotják. Sebestyén Zsolt Created Date. A protonok neutronok és az elektronok tulajdonságaival foglalkozunk.
I Vatommag 4 3 R3π 4 3 πR R0 3 A a térfogat arányos a tömegszámmal Vatommag A mivel a tömeg is arányos A-val ezért a sűrűség független tőle minden atommagnak kb. – Az atomok felépítésben az atommag és az elektronburok miben tér el. E B neutron E B proton 2.
A periódusos rendszer elején levő elemeknél a hidrogén kivételével az atommag ugyanannyi neutront tartalmaz mint ahány protont tehát a tömegszáma a rendszám kétszerese. Egy adott elem minden atomja teljesen egyforma. A szavakat elrejtettük a táblán.
Az atommag térfogata arányos a nukleonszámmal. Találja meg őket amilyen gyorsan csak lehet-. A mag teljes kötési energiája arányos a nukleonok számával A.
Melyik állitás nem igaz az atomokra. Ezért a 2 mm 10000-szeresét véve 20000 mm 20 méter. Rutherford-féle atommodell tudja ismertetni Rutherford atommodelljét szórási kísérletének eredményeit.
A magban minden nukleon nagyjából azonos energiával kötött. A 13-as rendszámú elemtől az alumíniumtól kezdve a neutronok száma növekedni kezd és.

Kemia 9 B I A Kemia Es Az Atomok Vilaga 2 Az Atom
Molekulak Es Vegyuletek Cikk Khan Academy

Kemia 7 3 Az Atomok Felepitese 3 3 Az Atomok Elektronszerkezete
Https Www Kfki Hu Csorgo Szeged Magfiz 12 00 Ajanlott Irodalom Raics Peter Debrecen

Kemia 7 3 Az Atomok Felepitese 3 6 Osszefoglalas

Kemia 9 B I A Kemia Es Az Atomok Vilaga 2 Az Atom

Altalanos Kemia Sulinet Tudasbazis